Structure et fonctionnement de l'ATP synthase (1/2)
Photosynthèse: retour au sommaire
-> Chapitre précédent: comment est synthétisé l'ATP?
L’ATP synthase des chloroplastes (comme celle des mitochondries et des bactéries) est une ATPase de type F, encore appelée F1Fo ATPsynthase. Cette enzyme de masse moléculaire élevée (entre 550 à 650 kDa) est constituée de deux domaines protéiques: un domaine membranaire (Fo) et un domaine extramembranaire (F1). Lorsque le gradient de protons est favorable, l’enzyme couple la synthèse de l’ATP (à partir de l’ADP et du Pi) au flux spontané de protons qui s’effectue à travers Fo vers la face de la membrane où se situe F1. Il est à noter que s’il n’y a pas de gradient de protons (ni potentiel de membrane ni gradient de pH) pour diriger la réaction de synthèse, la constante d’équilibre de la réaction favorise la réaction inverse d’hydrolyse (activité ATPase).
1 - Structure de l’ATPsynthase
Le domaine F1, hydrophile, (qui fait saillie dans le stroma) comprend 5 polypeptides (sous-unités α, β, δ, ϒ, ε,). La stoechiométrie des sous-unités est 3α, 3β, 1δ, 1ϒ, 1ε.
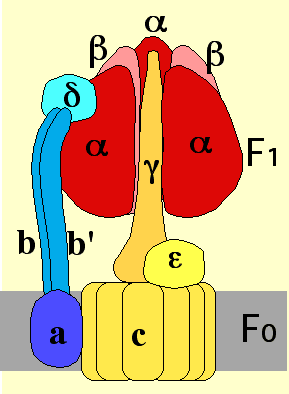
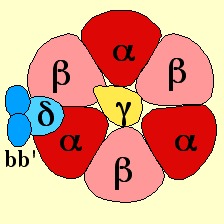
Structure de l'ATP synthase.
Vue de profil (une unité β a été enlevée pour visualiser l'unité centrale ϒ) et vue en coupe.
- Les sous-unités α et β sont homologues entre elles. Une vue apicale par rapport à la membrane montre une organisation en anneau (hexamère) dans lequel les sous-unités α et β sont en alternance.
- La structure cristalline du F1 établie par le groupe de J. Walker montre que la sous-unité ϒ forme une tige à l’intérieur de l’anneau constitué par les sous-unités α et β. A la base de la sous-unité ϒ (du côté Fo), on trouve la sous-unité δ et ε associées.
- Les 3 sites catalytiques de liaison des nucléotides sont situés aux interfaces α β avec une prédominance pour la sous-unités β.
- Chaque sous-unité α contient un site de fixation de l’ATP, mais ce site est inactif dans la catalyse (régulation).
- Les nucléotides adényliques se fixent aux sous-unités α et β avec le Mg2+ (cation indispensable).
- La sous-unité δ participe à la liaison de l'anneau des sous-unités α et β au domaine membranaire de l'enzyme.
Le domaine Fo est un complexe protéique intégré à la membrane. La stoechiométrie des sous-unités est 1a, bb', 10c.
Il est proposé que :
- les sous-unités c (très hydrophobes), sont formées de 2 hélices α transmembranaires. L’une de ces hélices renferme un groupement protonable, situé en position médiane, et qui réagit avec le DCCD (dicyclocarbodiimide), inhibiteur de l'ATP synthase. Les sous-unités c forment une "couronne" au sein de la membrane.
- la sous-unité a forme 2 demi canaux à protons permettant le passage des protons entre les deux faces de la membrane à l’intérieur de la bicouche. Le passage d’un demi canal à l’autre s’effectuant via les sous-unités c (cf.couplage énergétique de l’ATPsynthase).
- les 2 sous-unités bb' incluent une partie transmembranaire et un domaine très polaire, qui s’étend à l’extérieur de la membrane et établissent une liaison avec la partie F1 de l’enzyme via la sous unité δ.
- La figure représente un modèle simplifié d’agencement des sous-unités de l’enzyme résultante des travaux de J. Walker.
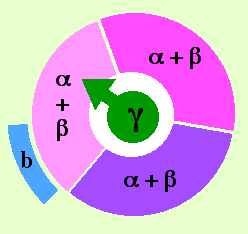
Schématisation de l'ATP synthase en coupe transversale.







