La famille des protéines Bcl-2
Les protéines de la famille Bcl-2 sont les principales actrices de la régulation de la voie apoptotique mitochondriale en modulant la libération, dans le cytosol, du cytochrome c mitochondrial. Ces protéines interviennent soit en bloquant (protéines anti-apoptotiques comme Bcl2, Bcl-XL, …) soit en favorisant (protéines pro-apototiques comme Bax, Bad, Bim, …) la libération du cytochrome c qui est considérée comme un point de non-retour dans l’apoptose.
Structure des protéines Bcl-2
La protéine Bcl-2 fut découverte pour la première fois dans le lymphome folliculaire humain à cellules B (B-cell lymphoma 2). Les protéines de la famille Bcl-2 sont classées en deux grandes catégories : les protéines pro-apototiques (Bax, Bak, Bad, Bid, Bim, etc ) et les protéines anti-apoptotiques (comme Bcl-2, Bcl-XL, Mcl-1, etc). Toutes les protéines de la famille Bcl-2 possèdent des domaines d'homologie à Bcl-2 (BH) conservés. Sur cette base, trois sous-groupes de la famille Bcl-2 ont été identifiés : (1) les membres multidomaines anti-apoptotiques (par exemple, Bcl-2, Bcl-xL et Mcl-1, etc) contenant les quatre domaines BH (BH1-4), (2) les membres multidomaines pro-apoptotiques (par exemple, Bax, Bak, etc) contenant trois domaines BH (BH1-3) et (3) les membres pro-apoptotiques "BH3 only" contenant uniquement le domaine BH3 (par exemple, Bad, Bid, Bim, Puma, Noxa, Bik, etc). De plus, de nombreuses protéines Bcl-2 contiennent un domaine hydrophobe d'ancrage transmembranaire (TM) à l'extrémité C-terminale leur permettant de se localiser sur les membranes intracellulaires. Ces protéines anti- et pro-apoptotiques interagissent entre elles et s’oligomérisent pour former des homodimères ou des hétérodimères. Le devenir de la cellule dépendra de la formation de ces dimères.
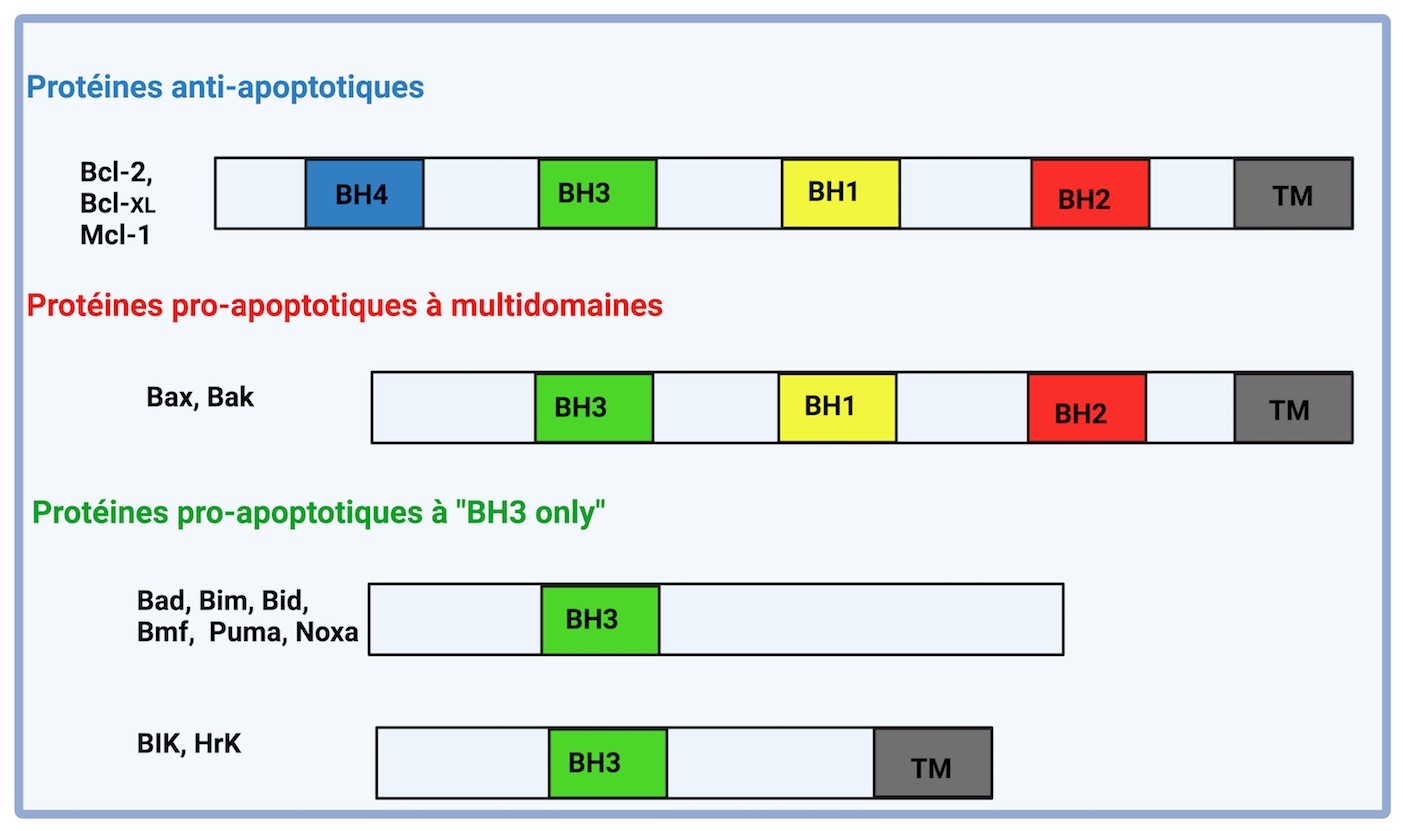
Classification des protéines de la famille Bcl-2 selon leurs domaines BH : Toutes les protéines de la famille Bcl-2 possèdent des domaines d'homologie à Bcl-2 (BH). Les protéines anti-apoptotiques en ont quatre (de BH1 à BH4). Les protéines pro-apoptotiques sont divisées en deux catégories : celles qui possèdent plusieurs domaines et celles qui ne possèdent que le domaine BH3 ("BH3 only"). Certaines protéines "BH3-only" possèdent un domaine transmembranaire (TM) (par exemple BIK ; Hrk). BH domaine : Bcl-2 Homology domaine; TM domaine : Trans Membranaire domaine.
La régulation de la permabilisation de la membrane externe de la mitochondrie
Les protéines Bcl-2, en interagissant entre elles vont contrôler la perméabilisation de la membrane externe mitochondriale et ainsi la libération du cytochrome c. Parmi les différentes protéines Bcl-2, la protéine pro-apoptotique Bax est un régulateur clé de l'apoptose. La stimulation apoptotique conduit à l’oligomérisation d’homodimères Bax/Bax et/ou d’hétérodimères Bax/Bak dans la membrane mitochondriale externe et à la formation de pores qui permettent la libération du cytochrome c dans le cytosol. Malgré d’intenses recherches, le mécanisme moléculaire impliqué dans la perméabilisation de la membrane externe mitochondriale est toujours à l’étude. En absence de stimuli apoptotiques, Bax est inactif en tant que monomère principalement situé dans le cytosol des cellules saines. En présence de stimuli apoptotiques, Bax transloque vers la membrane externe mitochondriale, où il subit un changement de conformation et s'oligomérise pour former les pores responsables de la perméabilisation des mitochondries. Plusieurs modèles ont été proposé afin d'expliquer la régulation de l'activité de Bax par d'autres membres de la famille Bcl-2. Le « modèle direct » le plus admis suppose que l'activation de Bax et la perméabilisation de membrane mitochondriale externe soient induites uniquement par les protéines « BH3 only » comme Bim, PUMA et la forme clivée de Bid (cBid) qui sont des activateurs directs de Bax. Par ailleurs, l'activité de Bax peut être inhibée par les protéines anti-apoptotiques comme Bcl-XL, MCL-1. Le rôle de Bc-XL serait de supprimer l'oligomérisation de Bak/Bax et/ou Bax/Bax en formant des hétéro-dimères avec eux (par example Bax/Bcl-XL ou/et Bak/Bcl-XL). Alternativement, les modèles d'activation «indirects» postulent que les protéines « BH3 only » perturbent l’oligomérisation de Bax/Bak en neutralisent plutôt les protéines anti-apoptotiques Bcl-2 qui empêchent l’oligomérisation de Bax et Bak dans des conditions non apoptotiques. Ainsi, les protéines pro-apoptotiques « BH3 only » en se liant de manière compétitive à Bcl-XL, MCL-1, libérent Bax/Bak ce qui leur permet de s’oligomériser et de former des pores.







