Les caspases
Structure des caspases
Les caspases sont des protéases à cystéines qui jouent un rôle primordial dans l’exécution de l’apoptose en clivant les protéines cibles qui maintiennent l’intégrité de la cellule ( Cibles cellulaires des caspases). Ces protéases possèdent un site catalytique comprenant un résidu cystéine localisé dans un pentapeptide très conservé QACXG (cystéine impliqué dans le processus catalytique). Ces enzymes reconnaissent et clivent des protéines cibles en position carboxy terminale (C-Ter) d’un résidu aspartate (D) situé en P1 d’un tétrapeptide p4XXXDp1. Dans leur forme inactive (procaspase ou zymogène), les caspases sont constituées d’un prodomaine, d’une grande sous-unité (portant le site catalytique) et d’une petite sous-unité. Toutes les caspases possèdent en position amino terminale (N-ter) un prodomaine de taille variable.
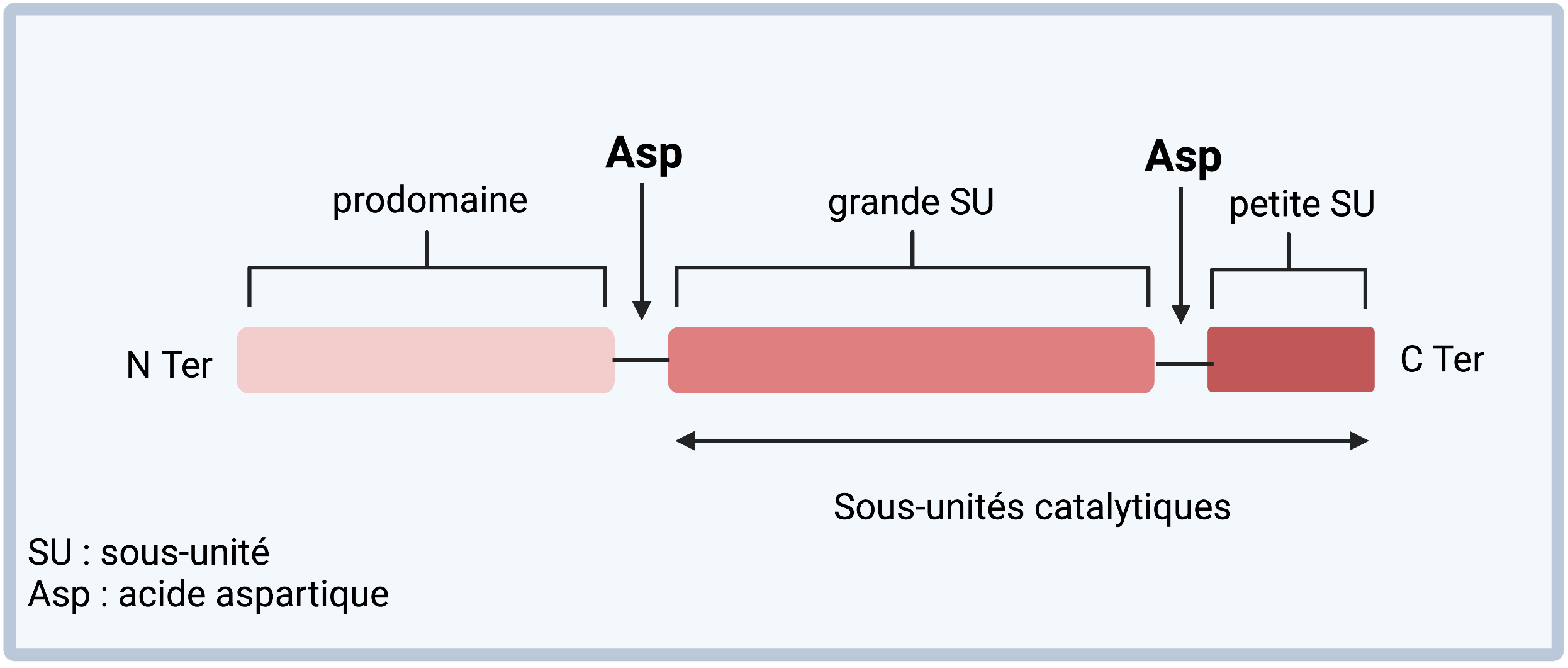
 Structure des caspases : Les caspases sont constituées d'un prodomaine, d'une grande sous-unité et d'une petite sous-unité. SU : sous-unité ; Asp : acide aspartique
Structure des caspases : Les caspases sont constituées d'un prodomaine, d'une grande sous-unité et d'une petite sous-unité. SU : sous-unité ; Asp : acide aspartique
La classification des caspases
Deux types de caspases sont répertoriées: les caspases initiatrices (caspase 2, 8, 9, 10) et les caspases effectrices (caspases 3,6,7). Les caspases initiatrices sont les premières à être activées lors de l’apoptose. Elles possèdent un long prodomaine constitué par des motifs d’interaction protéine-protéine, tels que les domaines DED (Death Effector Domain) pour les caspase 8 et 10 ou les domaines CARD (Caspase Activation Recruitement Domain) pour les caspases 9 et 2. Ces domaines DED et CARD jouent un rôle primordial dans l’activation des caspases initiatrices. L’activation des caspases initiatrices nécessite une dimérisation des procaspases au niveau des domaines DED ou CARD et leur auto-clivage au niveau du prodomaine et entre les grandes et petites sous-unités. (Animation Activation des caspases). Les caspases effectrices quant à elles possèdent un prodomaine plus court et ne possèdent pas de domaine DED ou CARD leur permettant d’être recrutées et de s’oligomériser en dimère comme les caspases initiatrices (Animation Activation des caspases). Les caspases effectives vont être activées par clivage par une caspase initiatrice active. L’activation des caspases se fait en cascade. Cette activation permet une amplification du signal initial ( Cascade d'activation des caspases).
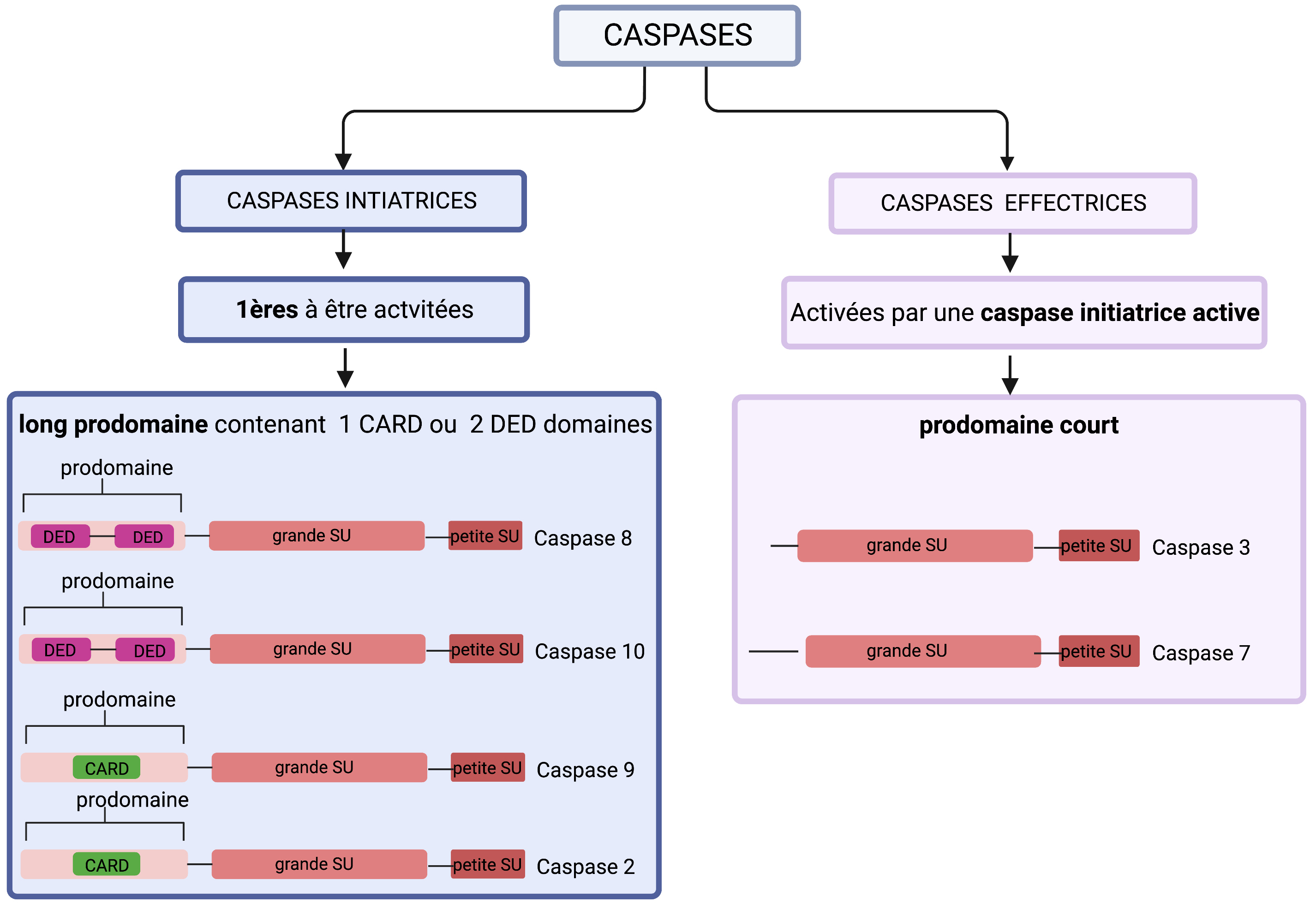
Classification des caspases : Les caspases initiatrices regroupent les caspases 2,8, 9, 10; les caspases effectrices regroupent les caspases 3,6,7. Les domaines DED et CARD sont domaines de recrutement protéiques (impliqués dans des interactions homotypiques entre protéines). DED : Death Effector Domain ; CARD: Caspase Activation Recruitment Domain.
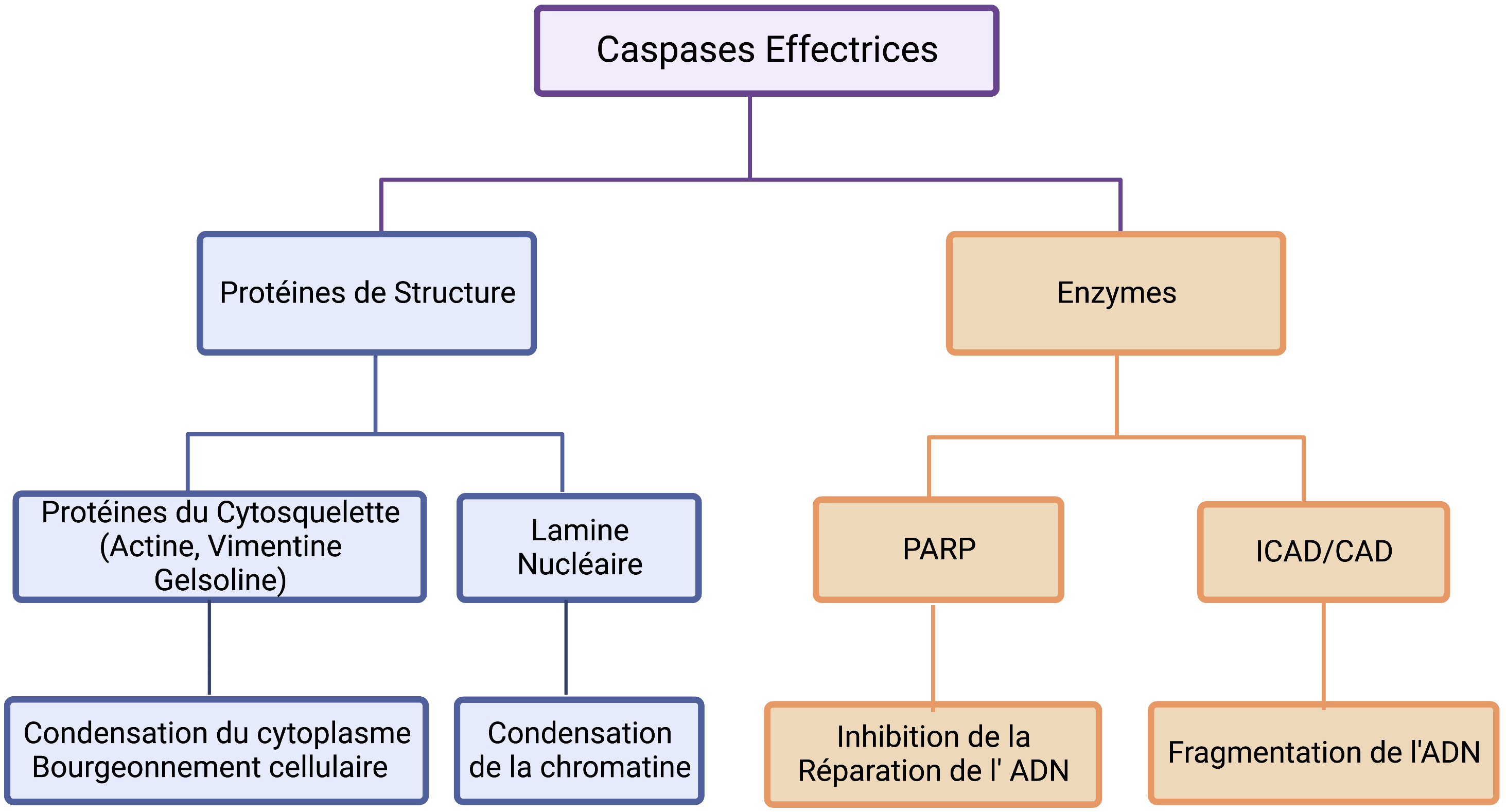
Les cibles cellulaires des caspases
Les caspases effectrices une fois activées vont avoir pour substrat des protéines qui jouent un rôle indispensable dans l’intégrité des cellules. Le clivage de ces différents protéines substrats sont à l’origine de la plupart des évènements morphologiques et biochimiques de l’apoptose. De nombreuses protéines sont clivées par les caspases lors de l’apoptose. Le clivage des protéines de structure comme les protéines du cytosquelette (actine, gelsoline, vimentine) va entrainer la condensation du cyttoplasme et le bourgeonnement de la cellule. Le clivage des lamines nucléaires va conduire à la condensation de la chromatine. Les caspases ont aussi des enzymes comme cibles. C’est le cas par exemple de la poly(ADP ribose) polymérase (PARP) qui participe à la réparation de l’ADN en absence d’apoptose. Les caspases clivent également ICAD (Inhibitor of Caspase Activated DNase) ce qui entraine la libération de la CAD ( Caspase Activated DNase) qui peut alors catalyser le clivage internucléosomique de l’ADN qui est caractéristique de l’apoptose.