Les propriétés acido-basiques des acides aminés (2)
Formes ioniques des acides aminés
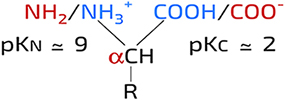
Les acides aminés possèdent à la fois une fonction acide faible (COOH) et une fonction base faible (NH2), ce sont des ampholytes ou molécules amphotères.
A pH très faible, les acides aminés sont tous des acides polyprotiques faibles : ils contiennent au moins deux atomes d'hydrogène dissociables, celui des groupements carboxylique et amine, portés par le carbone α. La charge positive de la fonction -NH3+ rend l'ionisation de la fonction -COOH plus probable, c'est à dire qu'elle abaisse le pKa de cette dernière (pKC). Le pKa normal pour un groupement carboxylique est d'environ 4,5 alors qu'il est de l'ordre de 2 pour celui d'un acide aminé. Le pKa de la fonction amine (pKN) est de l'ordre de 9.
L'animation suivante montre les différents états d'ionisation en fonction du pH d'un acide aminé à chaîne latérale non chargée, l'alanine. Celui-ci ne possède donc que deux pKa.
L'alanine existe sous trois formes ionisées possibles selon le pH de la solution.
A pH acide, l'alanine possède une charge nette positive (chlorure d'alanine).
Si on éleve le pH, l'alanine se retrouve sous forme dipolaire, totalement ionisée, électriquement neutre (forme zwitterion). Lorsque la forme zwitterion est à sa concentration maximale, ce pH caractéristique est appelé pH isoélectrique (pHi).Le pHi est égal à la demi somme des pKa qui entourent la forme zwitterion.
A pH basique, l'alanine possède une charge nette négative (alaninate de sodium ou alanine monosodique).








